Tematiche - Trattamento dell’acqua
299.1.084 / V6
3 Durezza dell’acqua
La durezza dell’acqua è un parametro di particolare importanza nella depurazione dell’acqua potabile. L’acqua dura è molto diffusa tanto in natura quanto nella rete di approvvigionamento di acqua potabile.
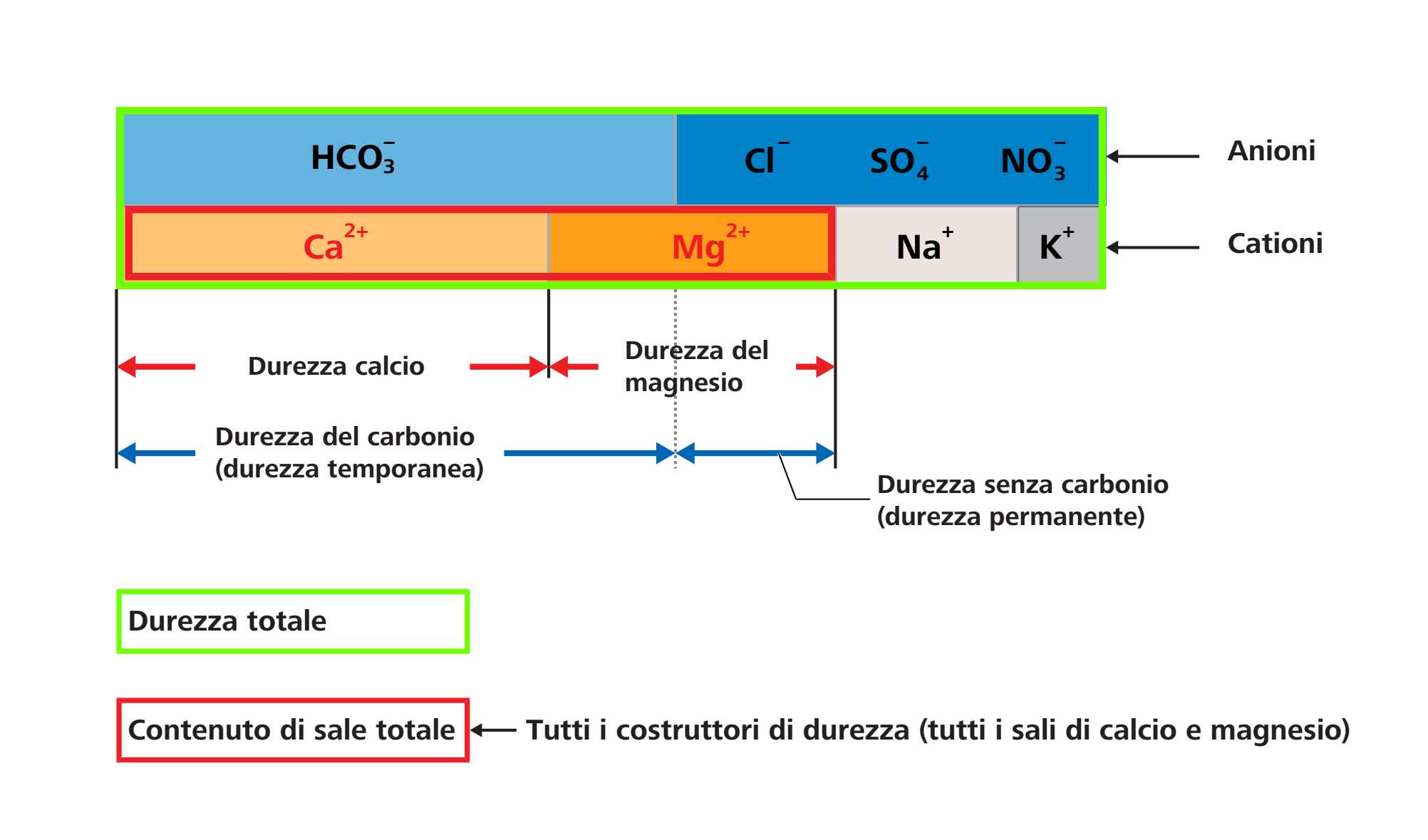
Nella chimica dell’acqua, con «durezza dell’acqua» si intende la concentrazione di ioni dei metalli alcalino-terrosi disciolti in acqua. In sostanza, gli ioni di calcio e magnesio contribuiscono a determinare la durezza dell’acqua perché possono formare composti scarsamente solubili. Tra essi rientrano, ad esempio, carbonati e idrogenocarbonati. Il calcio e il magnesio vengono collettivamente definiti anche «indurenti».
La durezza complessiva dell’acqua è composta dalla durezza carbonatica (durezza temporanea) e dalla durezza non carbonatica (durezza permanente).
Gli idrogenocarbonati di calcio e magnesio formano la durezza carbonatica che precipita come deposito di calcare riscaldando l’acqua. Cloruro, nitrati e solfati di calcio e magnesio formano la durezza non carbonatica che rimane invariata riscaldando l’acqua.

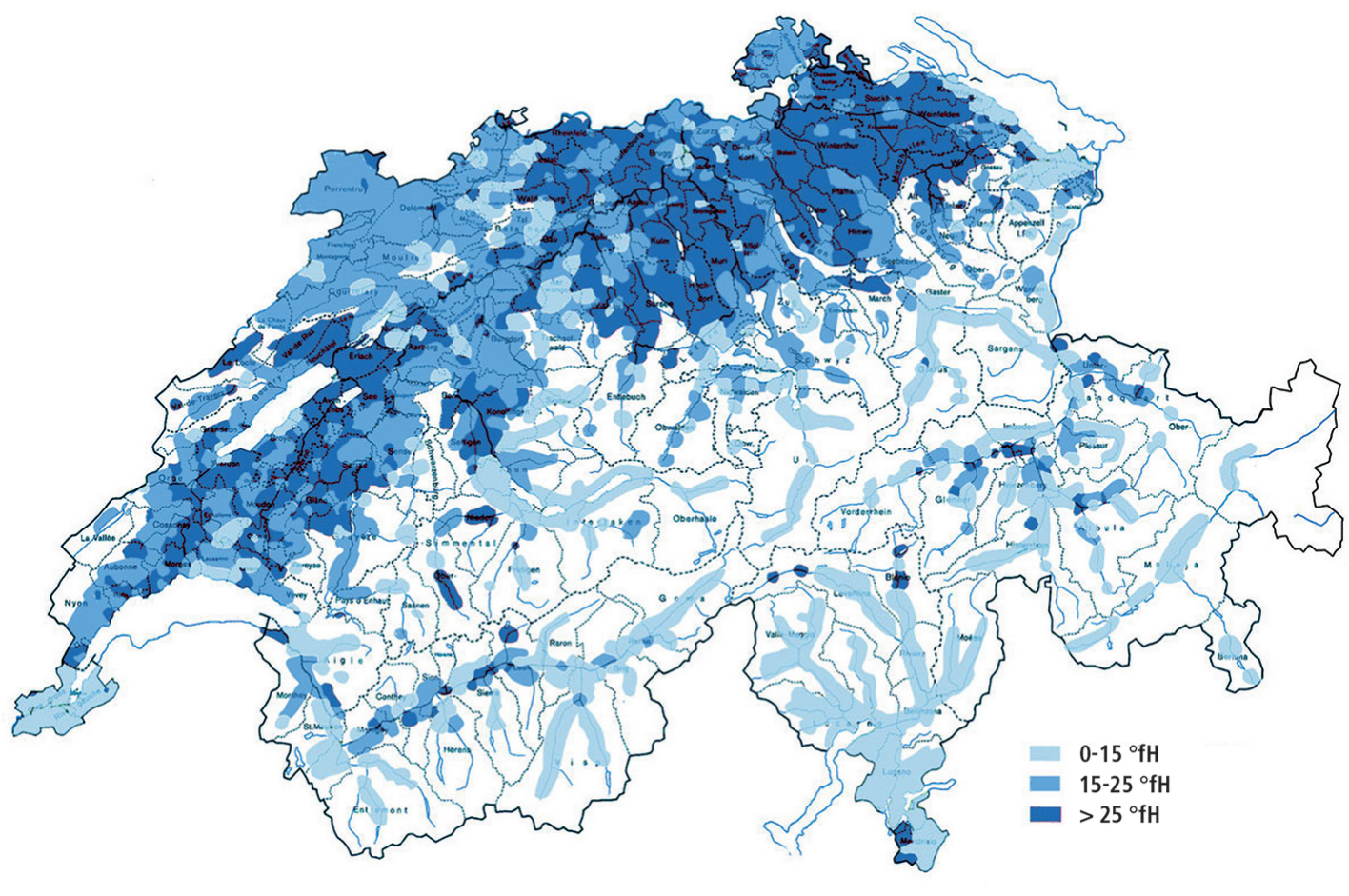
Informazioni sulla durezza dell’acqua in Svizzera possono essere richieste all’ente di approvvigionamento idrico competente.
3.1 Come il calcare giunge nell’acqua
L’acqua piovana si arricchisce di acido carbonico nell’atmosfera rilasciando nel terreno sali di calcio disciolti. Il tenore di sali di calcio disciolti può variare in base al tipo di terreno. L’acqua trasporta questi composti di calcare e acido carbonico nell’impianto idrico domestico ad esempio sotto forma di idrogenocarbonato di calcio. La concentrazione di sali di calcio disciolti nell’acqua potabile è determinante per la durezza dell’acqua.
3.2 Gradi di durezza dell’acqua
In base al Sistema Internazionale delle unità di misura (SI), la durezza complessiva dell’acqua viene indicata in mole per litro (mol/l) o in millimole per litro (mmol/l).
In passato, in Germania e in Austria la durezza dell’acqua veniva misurata in gradi di durezza tedeschi (°dH).
In Svizzera si utilizzano i gradi di durezza francesi (°fH).
Ai sensi della Legge sulle derrate alimentari, in Svizzera l’acqua viene suddivisa in sei gradi di durezza:
|
Denominazione |
Durezza complessiva [mmol/l] |
Durezza complessiva [°fH] |
|---|---|---|
|
Molto dolce |
< 0.7 |
< 7 |
|
Dolce |
0.7 … 1.5 |
7 … 15 |
|
Mediamente dura |
1.5 … 2.5 |
15 … 25 |
|
Abbastanza dura |
2.5 … 3.2 |
25 … 32 |
|
Dura |
3.2 … 4.2 |
32 … 42 |
|
Molto dura |
> 4.2 |
> 42 |
Gradi di durezza dell’acqua ai sensi della Legge sulle derrate alimentari
3.2.1 Conversione per unità di misura della durezza dell’acqua
|
mmol/l |
°fH |
°dH |
CaCO3 mg/l |
CaO mg/l |
|
|---|---|---|---|---|---|
|
mmol/l |
1 |
10 |
5.6 |
100 |
56 |
|
°fH |
0.1 |
1 |
0.56 |
10 |
5.6 |
|
°dH |
0.179 |
1.79 |
1 |
17.9 |
10 |
Esempio di conversione unità di misura per durezza dell’acqua
|
CaCO3: |
Il carbonato di calcio è una sostanza solida incolore e cristallina. |
|
CaO: |
L’ossido di calcio (chiamato anche calce viva o quicklime) è una polvere bianca che reagisce con l’acqua provocando un forte rilascio di calore. |
3.3 Necessità di addolcimento dell’acqua
Per addolcimento dell’acqua si intende l’eliminazione degli ioni di calcio (Ca2+) e di magnesio (Mg2+) disciolti nell’acqua potabile.
Considerata come genere alimentare, l’acqua non ha bisogno di alcun addolcimento. Gli ioni di calcio e di magnesio (indurenti) disciolti in acqua rientrano tra le sostanze minerali innocue e addirittura vitali per le persone.
Sul piano del gusto, l’acqua potabile dura viene spesso classificata in una categoria superiore rispetto all’acqua dolce. L’acqua dolce ha, d’altra parte, la capacità di esaltare meglio i sapori di caffè e tè.
L’acqua dura presenta tuttavia svantaggi per numerosi altri impieghi. Gli indurenti possono rappresentare un inconveniente quando l’acqua viene a contatto con sostanze alcaline, in particolare con saponi, o quando viene riscaldata, vaporizzata o evaporata.
Sempre più spesso si impiegano macchinari e apparecchiature con tecniche ancora più sofisticate ma anche più sensibili. Molti di essi necessitano di acqua addolcita.
La causa principale dei depositi di calcare consiste nell’alterazione dell’equilibrio naturale di calcio e acido carbonico determinato dal riscaldamento dell’acqua, con la conseguente precipitazione del carbonato di calcio nei punti più caldi sotto forma di calcare duro. Maggiore è la temperatura, più consistente è la precipitazione di calcio. Per motivi igienici e sanitari non è tuttavia possibile rinunciare al contempo a temperature elevate perché, con temperature troppo basse, aumenta il rischio di proliferazione di batteri quali le legionelle.
3.3.1 Vantaggi dell’acqua potabile addolcita
I principali vantaggi dell’acqua potabile addolcita sono:
-
Protezione da ostruzioni di calcare nelle tubazioni
-
Protezione da perdite di energia negli scaldacqua
-
Protezione da depositi di calcare nel bagno, sulle piastrelle e sui componenti idrosanitari
-
Prevenzione di guasti dovuti ai depositi di calcare negli elettrodomestici
-
Prolungamento della vita media degli elettrodomestici
-
Prevenzione di riparazioni costose
-
Protezione da depositi di calcare su bicchieri e stoviglie
-
Risparmio di detersivi o detergenti (fino al 50 %)
-
Protezione da biancheria ruvida e fibre che si sfaldano per le incrostazioni di calcare
-
Effetto positivo su pelle e capelli nell’igiene personale
-
Gusto più intenso di caffè e tè
3.3.2 Svantaggi dell’acqua potabile addolcita
Tra gli svantaggi principali dell’acqua potabile addolcita vi sono:
-
Rischio di corrosione delle condutture zincate e di rame Eliminazione di calcio e magnesio che determina il rilascio di acido carbonico libero in eccesso (aggressivo)
-
Alterazione del gusto dell’acqua
-
Rischio di contaminazione da germi dell’acqua potabile in caso di manutenzione inadeguata dell’addolcitore
-
Inquinamento ambientale dovuto al rilascio supplementare di sali indesiderati nelle acque reflue durante il processo di rigenerazione della resina per scambio di ioni
-
Costi operativi correnti (corrente elettrica, sale, manutenzione)
-
Perdita di pressione aggiuntiva nell’impianto di acqua potabile