Themenwelt - Wasserbehandlung
299.1.084 / V6
3 Wasserhärte
Die Wasserhärte ist ein Parameter von besonderer Bedeutung in der Trinkwassernachbehandlung. Hartes Wasser ist sowohl in der Natur als auch in der Trinkwasserversorgung sehr verbreitet.
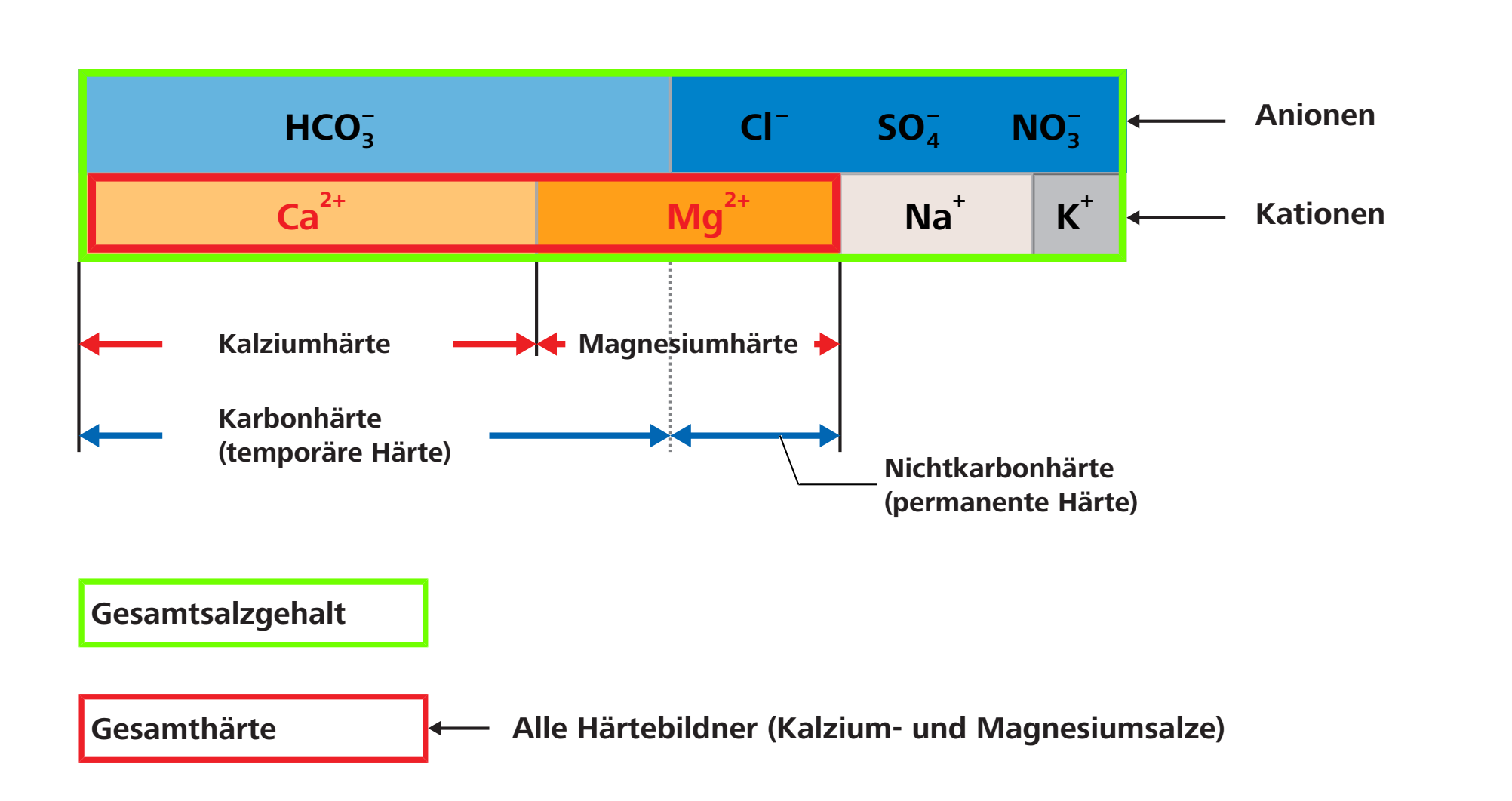
In der Wasserchemie wird mit Wasserhärte die Konzentration der im Wasser gelösten Ionen der Erdalkalimetalle bezeichnet. Im Wesentlichen tragen Kalzium- und Magnesiumionen zur Wasserhärte bei, da sie schwerlösliche Verbindungen bilden können. Dazu gehören z. B. Karbonate und Hydrogenkarbonate. Kalzium und Magnesium werden pauschal auch als «Härtebildner» zusammengefasst.
Die Gesamthärte des Wassers setzt sich zusammen aus der Karbonathärte (temporäre Härte) und der Nichtkarbonathärte (permanenten Härte).
Die Hydrogenkarbonate von Kalzium und Magnesium bilden die Karbonathärte, die beim Erhitzen des Wassers als Kalkablagerung ausfällt. Die Chloride, Nitrate und Sulfate von Kalzium und Magnesium bilden die Nichtkarbonathärte, die beim Erhitzen des Wassers nicht verändert wird.

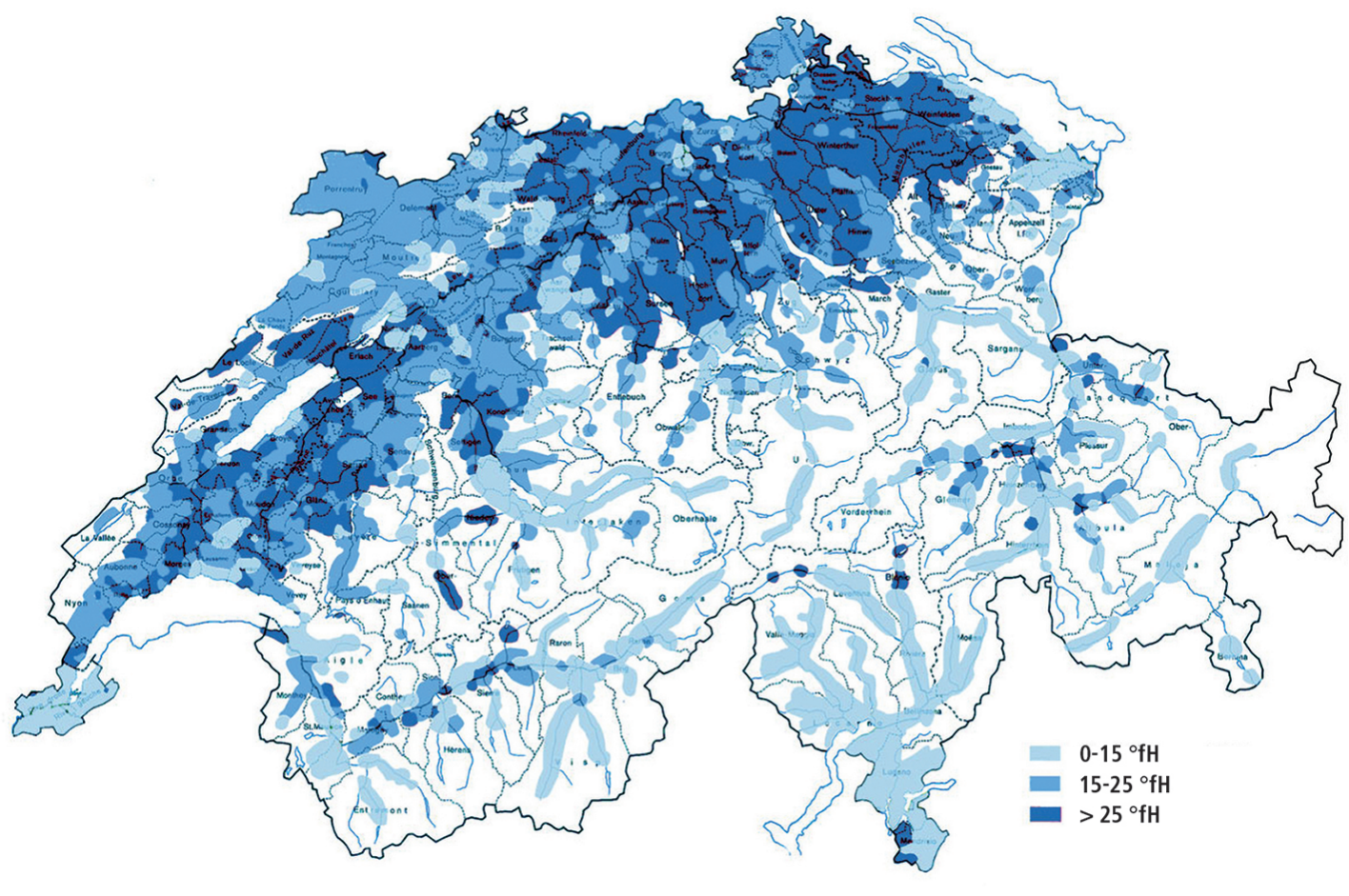
Auskunft zur Wasserhärte in der Schweiz kann bei der zuständigen Wasserversorgung angefragt werden.
3.1 Wie kommt der Kalk ins Wasser
Das Regenwasser reichert sich in der Atmosphäre mit Kohlensäure an. Dadurch werden im Boden Kalksalze gelöst. Je nach Bodenbeschaffenheit kann der Gehalt der gelösten Kalksalze variieren. Das Wasser transportiert diese Verbindungen von Kalk und Kohlensäure z. B. in Form von Kalziumhydrogenkarbonat in die Hauswasserinstallation. Die Konzentration der gelösten Kalksalze im Trinkwasser ist ausschlaggebend für die Wasserhärte.
3.2 Härtestufen von Wasser
Nach dem SI-Masssystem wird die Gesamthärte des Wassers in Mol pro Liter (mol/l) bzw. Minimol pro Liter (mmol/l) angegeben.
In Deutschland und Österreich wurde die Wasserhärte früher in deutschen Härtegraden (°dH) gemessen.
In der Schweiz sind die französischen Härtegrade (°fH) gebräuchlich.
Gemäss Lebensmittelgesetz wird das Wasser in der Schweiz in 6 Härtestufen eingeteilt:
|
Bezeichnung |
Gesamthärte [mmol/l] |
Gesamthärte [°fH] |
|---|---|---|
|
Sehr weich |
< 0.7 |
< 7 |
|
Weich |
0.7 … 1.5 |
7 … 15 |
|
Mittelhart |
1.5 … 2.5 |
15 … 25 |
|
Ziemlich hart |
2.5 … 3.2 |
25 … 32 |
|
Hart |
3.2 … 4.2 |
32 … 42 |
|
Sehr hart |
> 4.2 |
> 42 |
Härtestufen von Wasser gemäss Lebensmittelgesetz
3.2.1 Umrechnung für die Einheiten der Wasserhärte
|
mmol/l |
°fH |
°dH |
CaCO3 mg/l |
CaO mg/l |
|
|---|---|---|---|---|---|
|
mmol/l |
1 |
10 |
5.6 |
100 |
56 |
|
°fH |
0.1 |
1 |
0.56 |
10 |
5.6 |
|
°dH |
0.179 |
1.79 |
1 |
17.9 |
10 |
Umrechnungsbeispiel Einheiten Wasserhärte
|
CaCO3: |
Kalziumkarbonat (oder kohlensaurer Kalk) ist ein farbloser, kristalliner Feststoff. |
|
CaO: |
Kalziumoxid (auch gebrannter Kalk, Branntkalk, ungelöschter Kalk, Kalkerde oder Ätzkalk) ist ein weisses Pulver, das mit Wasser unter starker Wärmeentwicklung reagiert. |
3.3 Notwendigkeit von Wasserenthärtung
Unter Wasserenthärtung versteht man die Entfernung von im Trinkwasser gelösten Kalzium- (Ca2+) und Magnesiumionen (Mg2+).
Wasser, als Lebensmittel betrachtet, bedarf keiner Enthärtung. Die im Wasser gelöste Kalzium- und Magnesiumionen (Härtebildner) gehören zu den Mineralstoffen, die für den Menschen unbedenklich und sogar lebensnotwendig sind.
Hartes Trinkwasser wird geschmacklich oft als besser eingestuft als weiches Wasser. Dafür hat weiches Wasser aber die Fähigkeit, die Geschmackstoffe aus Kaffee und Tee besser herauszulösen.
Für viele andere Verwendungszwecke kann sich allerdings hartes Wasser als nachteilig erweisen. Die Härtebildner können überall dort stören, wo das Wasser mit alkalischen Stoffen, insbesondere mit Seifen, in Berührung kommt, oder dort wo es erwärmt, verdampft oder verdunstet wird.
Es werden immer mehr Maschinen und Geräte mit verfeinerter, aber auch empfindlicher Technik eingesetzt. Viele benötigen enthärtetes Wasser.
Die Hauptursache der Kalkablagerungen liegt darin, dass durch die Erwärmung des Wassers das natürliche Kalk-Kohlensäure-Gleichgewicht verändert wird und dadurch Kalziumkarbonat in Form von hartem Kalkstein an den wärmsten Stellen ausfällt. Je höher die Temperatur, desto mehr Kalk wird ausgefällt. Gleichzeitig kann auf hohe Temperaturen aus hygienischen und gesundheitlichen Gründen nicht verzichtet werden, da bei zu niedriger Temperatur die Gefahr der Vermehrung von Bakterien, z. B. Legionellen, zunimmt.
3.3.1 Vorteile von enthärtetem Trinkwasser
Die wichtigsten Vorteile von enthärtetem Trinkwasser sind:
-
Schutz vor Kalkinfarkt in Rohrleitungen
-
Schutz vor Energieverlusten im Wassererwärmer
-
Schutz vor Kalkablagerungen im Bad, auf Fliesen und auf sanitären Komponenten
-
Vorbeugung von Störungen durch Kalkablagerung bei Haushaltsgeräten
-
Verlängerung der Lebensdauer von Haushaltsgeräten
-
Vermeidung kostenintensiven Reparaturen
-
Schutz vor Kalkablagerungen bei Gläsern und Geschirr
-
Einsparung von Wasch- und Spülmitteln (bis zu 50 %)
-
Schutz vor rauer Wäsche und brüchigen Fasern durch Kalkseifen
-
Positive Wirkung auf Haut und Haare bei der Körperpflege
-
Intensiverer Kaffee- und Teegeschmack
3.3.2 Nachteile von enthärtetem Trinkwasser
Zu den wichtigsten Nachteilen von enthärtetem Trinkwasser zählen:
-
Gefahr von Korrosion bei verzinkten sowie bei Kupferleitungen. Durch den Entzug von Kalzium und Magnesium wird freie überschüssige (aggressive) Kohlensäure freigesetzt.
-
Geschmackliche Veränderung des Wassers
-
Gefahr von Verkeimung des Trinkwassers bei unsachgemässem Unterhalt der Enthärtungsanlage
-
Umweltbelastung durch zusätzlichen Anfall von unerwünschten Salzen im Abwasser beim Regenerationsprozess des Ionenaustauscherharzes
-
Laufende Betriebskosten (Strom, Salz, Wartung)
-
Zusätzlicher Druckverlust in der Trinkwasseranlage