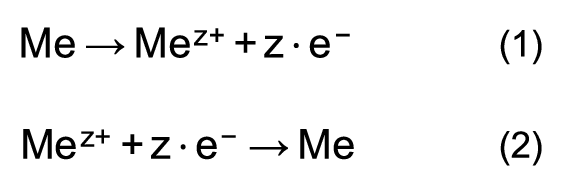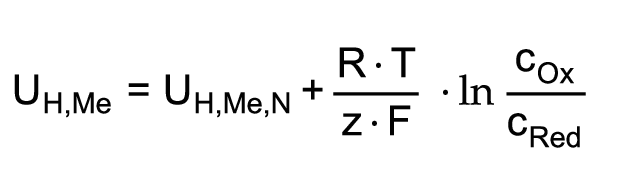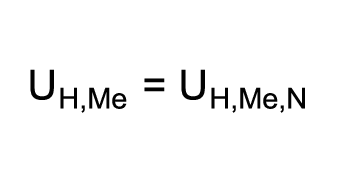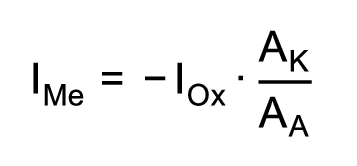Thématiques - Corrosion
2.1 Formation d’un potentiel
Le potentiel est une propriété des métaux telle que la dureté ou la conductibilité électrique. Cela s’entend toujours en rapport avec une solution aqueuse dans laquelle se trouve le métal.
Lorsqu’un métal est plongé dans une solution aqueuse, il existe des états de déséquilibre thermodynamique entre le métal et la solution aqueuse, ce qui s’explique notamment par des différences de concentration de matières dans les deux phases. Ces états de déséquilibre se traduisent par des interactions caractérisées par des ions et électrons en mouvement. On assiste alors à la migration d’ions depuis le métal vers la solution aqueuse, et vice versa. Ces mouvements transitoires sont des réactions électrochimiques qui se poursuivent jusqu’à ce que s’installe un équilibre thermodynamique. Comme les ions sont des porteurs de charge, on assiste à des changements de potentiel. De ce fait, ce sont les ions, à savoir leur nombre et leur charge électrique, qui déterminent le potentiel d’un métal.
Les deux réactions peuvent être représentées par les formules de réaction suivantes:
|
Symbole |
Unité |
Description |
|---|---|---|
|
Me |
— |
Métal, dans son état atomique |
|
Mez+ |
Ion métallique, valeur z (unité de charge positive) |
|
|
z |
Nombre d’électrons |
|
|
e− |
Electron (unité de charge négative) |
La formule de réaction (1) décrit la dissolution du métal. Les ions circulent du métal vers la solution aqueuse. On désigne cette opération aussi par pression de mise en solution. On parle aussi de processus anodique ou de réaction anodique.
La formule de réaction (2) décrit le dépôt de métal. Les ions circulent de la solution aqueuse vers le métal. On désigne cette opération aussi par pression osmotique. On parle aussi de processus cathodique ou de réaction cathodique.
Les deux réactions se déroulent simultanément durant l’immersion d’un métal, toutefois souvent à des vitesses différentes. Lorsque la réaction (1) se déroule plus rapidement que la réaction (2), le métal est chargé négativement au début des réactions en raison de l’accumulation d’électrons. Les métaux qui réagissent ainsi sont dits non-nobles. Dans le cas inverse, le métal est chargé positivement en raison de la plus grande vitesse de dépôt. Ces métaux sont dits nobles.
Sur les couches de la limite de phases métal/solution se crée donc une différence de potentiel comparable avec celle entre les plaques d’un condensateur. Cette tension électrique est dite potentiel Galvani et ne peut pas être mesurée.
2.2 Mesure du potentiel
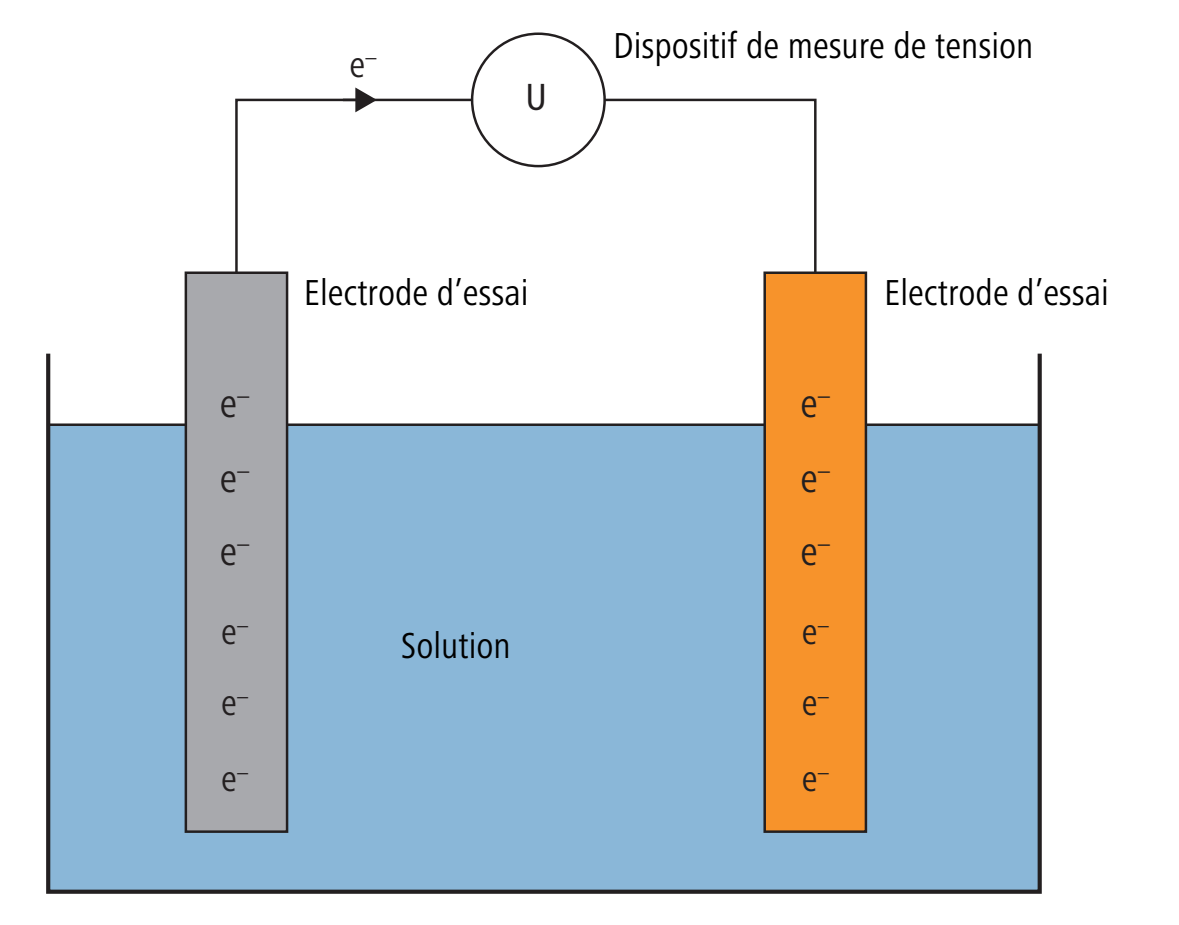
Le potentiel d’un métal ne peut être mesuré que par rapport au potentiel d’un deuxième métal. Autrement dit, on mesure la différence des deux potentiels Galvani. Cette différence de tension est dite potentiel d’électrode*.
L’illustration suivante montre le dispositif de mesure du potentiel d’électrode entre l’électrode d’essai et une électrode de référence. En présence de différences de potentiel Galvani de l’électrode d’essai et de l’électrode de référence, le dispositif de mesure de tension indique une tension.
Pour mesurer les potentiels d’électrodes de divers métaux à des fins de comparaison, il faudrait connaître le potentiel Galvani de chaque métal. Le potentiel Galvani n’est toutefois ni mesurable ni calculable. C’est pourquoi le potentiel d’électrode d’hydrogène a été défini avec la valeur arbitraire de 0 volt comme potentiel standard (ou potentiel normal), la température de la solution étant de 25 °C et la concentration de 1 mol/litre. En s’appuyant sur ce potentiel standard ainsi défini, il est possible de comparer entre eux divers métaux.
Pour des raisons pratiques. on n’utilise pas l’hydrogène comme électrode de référence, mais une autre électrode, p. ex. l’électrode au calomel. L’électrode au calomel présente un potentiel d’électrode de 0.25 volt par rapport au potentiel standard de l’hydrogène.
* La désignation de potentiel d’électrode est à proprement parler incorrecte puisqu’il s’agit d’une différence de potentiel, et donc d’une tension.
2.3 Equation de Nernst
Pour comparer le potentiel d’électrode de différents métaux entre eux, il faut tenir compte non seulement de l’électrode de référence mais aussi de la solution aqueuse (électrolyte). Il suffit en effet d’expériences très simples pour constater qu’un métal réagit différemment dans des solutions de composition chimique identique mais aux concentrations de matières différentes.
Le rapport entre le potentiel d’électrode d’un métal et la concentration des ions formateurs de potentiel est exprimé par l’équation de Nernst:
|
Symbole |
Unité |
Description |
|---|---|---|
|
UH,Me |
V |
Potentiel d’électrode du métal Me |
|
UH,Me,N |
V |
Potentiel normal du métal Me par rapport à l’électrode normale à hydrogène |
|
R |
J/(mol⋅K) |
Constante de gaz 8.31447 |
|
z |
— |
Nombre d’électrons |
|
F |
J/(V⋅mol) |
Constante de Faraday 96485 |
|
cOx |
mol/l |
Concentration de matières de l’oxydant |
|
cRed |
mol/l |
Concentration de matières du réducteur |
L’équation montre que le potentiel d’électrode s’accroît lorsque:
-
la concentration de matières de l’oxydant dans la solution est augmentée,
-
et que la température de la solution est augmentée.
Comme solution, on peut par exemple utiliser de l’acide chlorhydrique (HCl). Un acide chlorhydrique de forte concentration contient une concentration en oxydant plus élevée H2. Le potentiel d’électrode du métal se trouvant dans l’acide chlorhydrique augmente, de même que sa réaction. C’est aussi le cas lorsque la température de l’acide chlorhydrique est augmentée.
L’équation suivante est une forme simplifiée de l’équation de Nernst. On peut l’appliquer uniquement pour une température de solution de 25 °C et pour des solutions diluées, que l’on rencontre souvent en présence de corrosion:
|
Symbole |
Unité |
Description |
|---|---|---|
|
UH,Me |
V |
Potentiel d’électrode du métal Me |
|
UH,Me,N |
V |
Potentiel normal du métal Me par rapport à l’électrode normale à hydrogène |
|
z |
— |
Nombre d’électrons |
|
cMe |
mol/l |
Concentration de matières des ions métalliques (logarithme décimal) |
Lorsque l’on utilise la concentration de matières cMe de 1 mol/l dans l’équation simplifiée de Nernst, la partie logarithmique de l’équation est égale à zéro (log1 = 0). On obtient l’équation suivante:
L’équation exprime que le potentiel d’électrode d’un métal est égal à son potentiel normal lorsque le métal est plongé dans une solution de concentration de matières de ses ions métalliques de 1 mol/l. L’équation définit le potentiel normal et constitue ainsi une base pour la création de séries de potentiels électrochimiques.
2.4 Série de potentiels électrochimiques
Les séries de potentiels électrochimiques servent à comparer les potentiels de métaux. Dans de nombreuses séries électrochimiques, on utilise le potentiel normal comme grandeur de comparaison et l’électrode normale à hydrogène comme électrode de référence. Des mesures permettent cependant de créer également d’autres séries de potentiels électrochimiques.
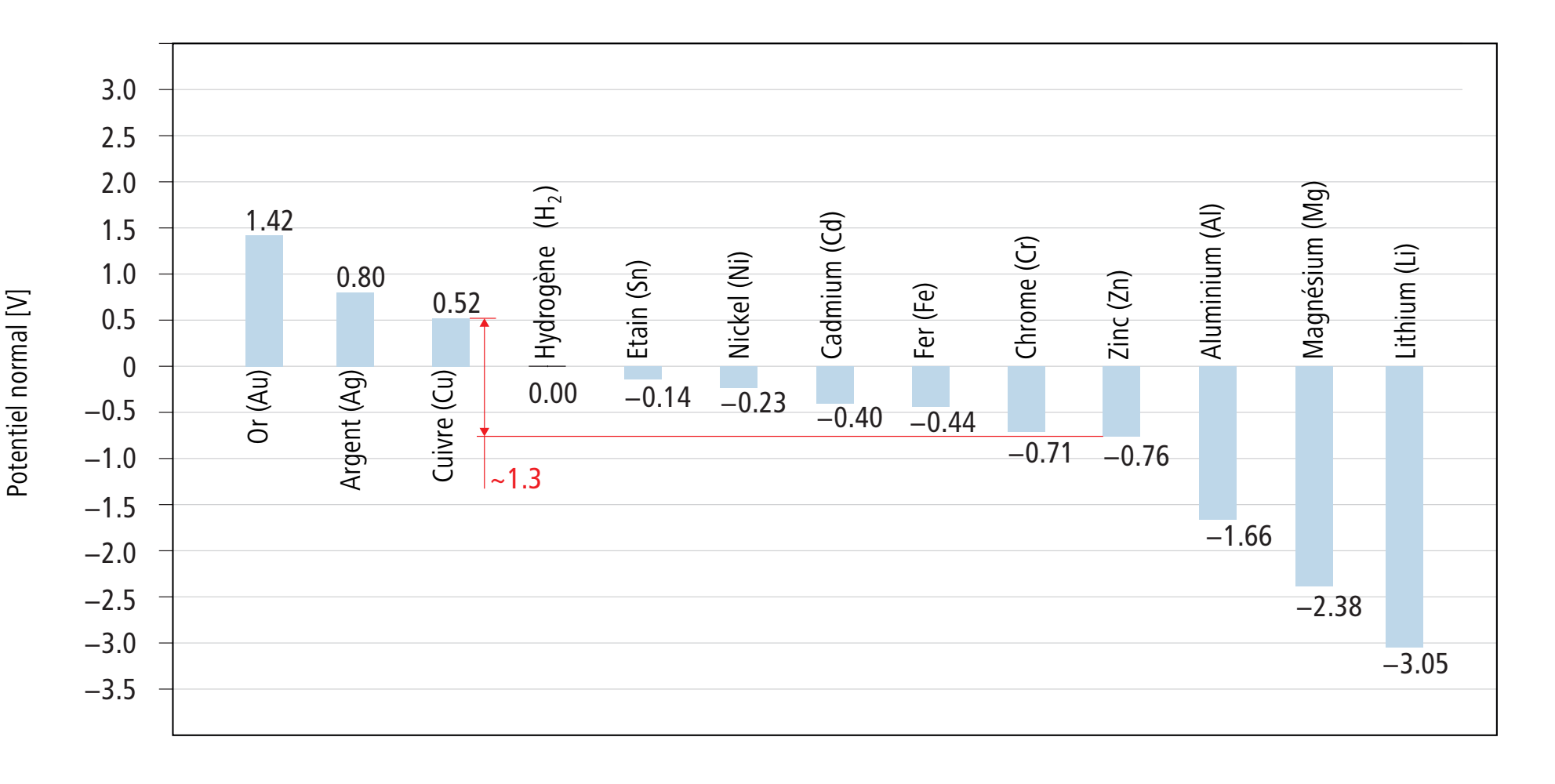
La représentation suivante montre les potentiels normaux de plusieurs éléments par rapport à l’électrode normale à hydrogène.
Pour déterminer la différence de potentiel de deux matériaux qui forment ensemble un élément galvanique, on calcule la différence de leurs potentiels. C’est ainsi par exemple que d’après la représentation ci-dessus, la différence de potentiel entre une électrode de cuivre et une électrode de zinc est d’environ 1.3 volt.
Le tableau suivant montre les potentiels de matériaux souvent utilisés dans la technique d’installation, les mesures portant sur les potentiels des métaux dans l’eau de boisson par rapport à une électrode à sulfate de cuivre.
|
Matériau |
Potentiel E* [V] |
|---|---|
|
Cuivre |
-0.10 |
|
Acier anticorrosion |
-0.10 |
|
Bronze et bronze au silicium |
-0.20 |
|
Laiton |
-0.35 |
|
Fer |
−0.55**/−0.75*** |
|
Acier galvanisé |
-0.75 |
|
* dans de l’eau de boisson par rapport à une électrode à sulfate de cuivre ** eau de boisson aérée ** eau de boisson stagnante |
|
Série de potentiels électrochimiques (selon la notice suissetec W10018)
2.5 Eléments galvaniques
Une différence de potentiel peut être mesurée entre deux électrodes de potentiel différent plongées dans un électrolyte. Cette tension induit un courant dans un circuit électrique fermé. Une telle disposition est dite élément galvanique, cellule galvanique ou tout simplement élément.
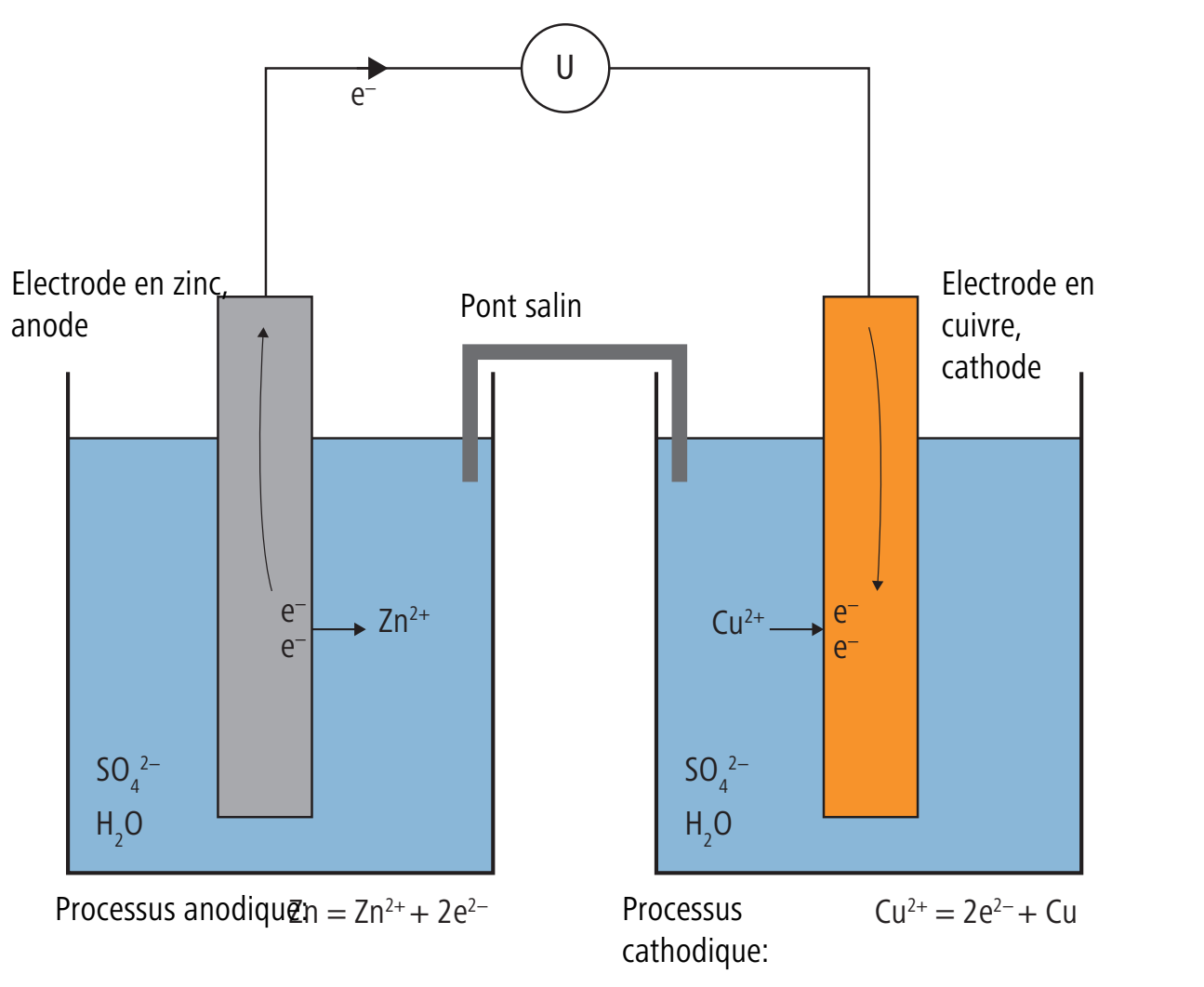
Dans l’histoire de l’électrochimie, l’élément Daniell occupe une place importante puisqu’il est à l’origine historique de la définition actuelle de l’unité pour la tension électrique. L’élément Daniell est constitué d’une électrode en cuivre et d’une électrode en zinc. L’électrode en cuivre est plongée dans une solution de sulfate de cuivre, l’électrode en zinc dans une solution de sulfate de zinc. Les deux solutions se trouvent dans des récipients séparés pour empêcher tout mélange. Le pont salin permet le passage d’ions et donc la circulation du courant.
Le zinc passe en solution sur l’électrode en zinc. Les électrons ainsi libérés circulent comme courant électrique jusqu’à l’électrode en cuivre, où se forme un dépôt de cuivre. Le courant circule jusqu’à ce que l’électrode en zinc soit complètement dissoute.
Le calcul du potentiel de l’élément Daniell à l’aide de l’équation Nernst donne comme valeur 1.1 volt.
2.6 Courant de corrosion et règles des surfaces
Le courant de corrosion est déterminé par la différence de potentiel électrochimique et d’autres paramètres:
-
Composition et propriétés de l’électrolyte, p. ex. conductibilité, valeur pH, teneur en oxygène, teneur en sels et température.
-
Environnement tel qu’humidité de l’air, présence dans l’air de substances agressives et corrosives.
-
Présence éventuelle de couches passives ou de revêtements.
La densité du courant de corrosion détermine la vitesse de corrosion. Une densité élevée du courant de corrosion accélère la corrosion du métal non-noble. Plus la surface du métal non-noble est petite par rapport à la surface du métal noble, plus la densité du courant de corrosion est élevée. Ceci est exprimé par la formule suivante:
|
Symbole |
Unité |
Description |
|---|---|---|
|
İMe |
[A] |
Courant anodique |
|
IOx |
[A] |
Courant cathodique |
|
AK |
[m2] |
Surface cathodique |
|
AA |
[m2] |
Surface anodique |
La vitesse de corrosion est proportionnelle au courant anodique, c.-à-d. que plus le courant anodique est important, plus la vitesse de corrosion est élevée. Dans la formule, le signe moins est attribuable au fait que la valeur du courant anodique est identique à celle du courant cathodique et que, par rapport à un nœud dans le circuit électrique, ces courants circulent dans le sens inverse (la somme des courants partiels dans un circuit fermé est égale à zéro).
La figure suivante montre une représentation schématique de la règle de surface:

2.7 Les catégories de corrosion atmosphérique
La corrosion atmosphérique désigne la désagrégation d’un matériau, qui résulte de l’interaction entre ce matériau et l’atmosphère naturelle environnante, à température ambiante. Selon la norme EN ISO 12944-2, les environnements atmosphériques sont divisés en catégories de corrosivité atmosphérique.
|
Catégorie de corrosivité |
Exemples d’environnements typiques (à titre informatif seulement) |
|
|---|---|---|
|
Air libre |
Intérieur |
|
|
C1 insignifiant |
— |
Immeubles chauffés à atmosphère neutre, p. ex. bureaux, locaux de vente, écoles, hôtels |
|
C2 faible |
Atmosphère à faible degré de pollution: en général dans des régions rurales |
Immeubles non chauffés à condensation possible, p. ex. entrepôts, salles de sport |
|
C3 moyen |
Atmosphère urbaine et industrielle à pollution moyenne en dioxyde de soufre; atmosphère côtière faiblement impactée par le sel |
Locaux de production à forte hygrométrie et avec un certain taux de pollution, p. ex. usines de transformation d’aliments, blanchisseries, brasseries, laiteries |
|
C4 élevé |
Atmosphère industrielle et atmosphère côtière moyennement impactée par le sel |
Installations chimiques, piscines, chantiers navals côtiers et ports de plaisance |
Catégories de corrosivité selon EN ISO 12944-2:2017
Le tableau suivant contient une liste des matériaux et revêtements fréquemment utilisés dans la technique sanitaire, avec en regard leur résistance aux atmosphères d’après les catégories de corrosivité selon EN ISO 12944-2:2017.
|
Catégorie de corrosivité |
Matériaux et revêtements |
||
|---|---|---|---|
|
Acier galvanisé |
Acier inoxydable |
Matières synthétiques |
|
|
C1 insignifiant |
|
|
|
|
C2 faible |
Mesure de protection supplémentaire nécessaire, p. ex. revêtement en matière synthétique ou flexible de protection |
|
|
|
C3 moyen |
Mesure de protection supplémentaire nécessaire, p. ex. revêtement en matière synthétique ou flexible de protection |
|
|
|
C4 élevé |
Mesure de protection supplémentaire nécessaire, p. ex. revêtement en matière synthétique ou flexible de protection |
Mesure de protection supplémentaire nécessaire, p. ex. revêtement en matière synthétique ou flexible de protection |
|
Résistance des matériaux de tubes aux atmosphères selon la norme EN ISO 12944-2:2017